216年过去了,人类离攻克癌症还有多远?AI医疗或许会是那个“破局者” 原创
1809年,美国肯塔基州的伊弗雷姆·麦克道尔(Ephraim McDowell)在没有用麻醉的情况下切除了一个22磅的卵巢肿瘤,该患者此后成功生活了30年,这是针对癌症的首例手术。
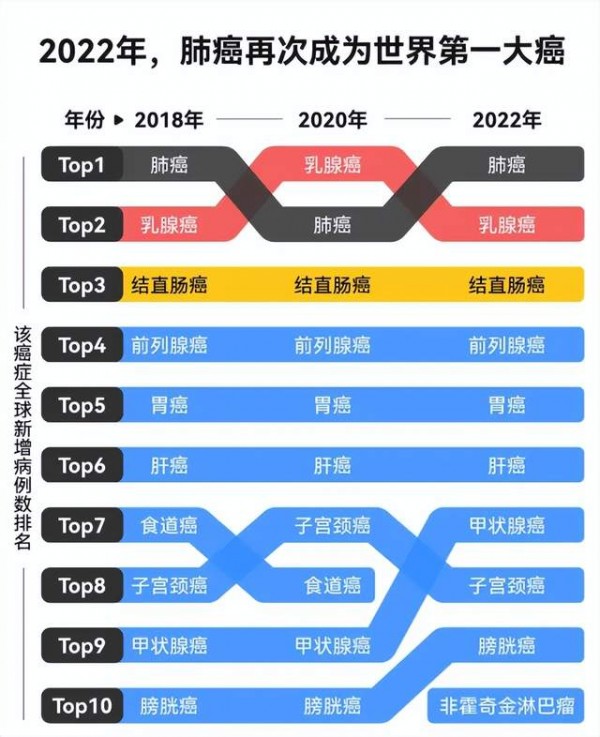
216年过去了,在医疗高度发达的今天,全球依然有大约五分之一的人会得癌症,而且有九分之一的男性和十二分之一的女性会死于癌症。其中,肺癌是第一杀手,每年死亡病例占所有癌症死亡病例的19%。
抗癌,看似依然是无解的难题…
AI的出现,或许让事情出现了转机,今年年初,宁波人民医院联合阿里部署了DAMO PANDA胰腺癌筛查AI模型,从7万份常规检查的人中发现了12例胰腺癌患者,其中6例常规平扫CT检查未提示有胰腺病变。
也就是说,AI能让够更早,更准确的发现并预测癌变的发生,这也是目前AI医疗的的一个主流发展方向,更早的发现,更准确的预测。
最近一项来自美国国立卫生研究院(NIH)的研究就在对肺癌精准预测方向上取得了重大突破。
目前医院主要依靠低剂量CT扫描来筛查高危患者,但这面临一个很现实挑战:放射科医生每天要处理多个检查,工作量巨大,而且需要手动测量多个病灶的尺寸变化,耗时费力,还容易因为主观判断和设备差异导致测量不一致。
美国国立卫生研究院的这项研究就是为了解决这种问题,其通过AI影像不仅能看到肺部病灶的当前状态,还能通过精准预测,追踪它们随时间的变化轨迹。
研究背景:以数据为基石
这项研究来自美国国立卫生研究院(NIH)的影像科学团队,于2025年发表在预印本平台arXiv上,获得了NIH临床中心内部研究项目的资助。
第一作者Tejas Mathai博士及其团队在医学影像AI领域颇有建树,特别是在深度学习应用于医学图像分析方面积累了丰富经验;他们在长期的临床实践中注意到,当前AI在肺癌影像分析领域虽然取得了长足进展,但在“长期追踪病灶体积”这一任务上,研究却相对空白。
这项研究使用了UniToChest数据集,这是一个公开的、由意大利医院采集的大型肺部CT影像数据集,包含700多例患者的超过1万处肺部结节手工标注,这为研究团队提供了丰富、可复现的训练和评估基础。
核心成果:从“定格拍照”到“延时摄影”
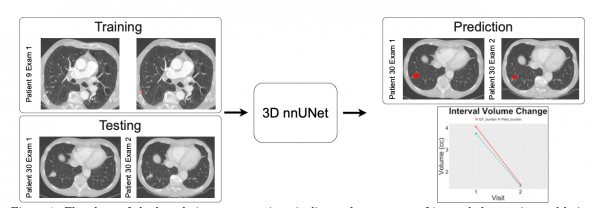
这项研究的核心成果非常务实,仅凭一个通用分割模型,对肺部多个病灶进行自动追踪,并输出可信的体积变化曲线。
传统的AI肺部检测只能告诉你哪里有一个病灶,大小是X厘米。而这个新系统更像一个"时间观察员",它能告诉你这个病灶在过去几个月里是如何变化的,总的肿瘤负荷是增加了还是减少了。
研究团队开发了两套基于3D nnUNet的深度学习模型,第一套模型被称为"noPriors",直接从CT图像中学习识别肺部病灶。
第二套模型叫"withPriors",在训练时额外加入了28种解剖结构的先验知识,比如肺叶、血管、气道等,像给AI医生提供了一张详细的解剖地图,帮助它更好地区分正常组织和病变组织
比较令人意外的是,实验结果显示没有加入先验数据的 "noPriors" 模型的表现反而更好,对于临床上最关心的大于1厘米的病灶,这个模型达到了71.3%的精确率和68.4%的敏感性。就是在它认为有问题的地方,71.3%确实有问题;而在真正有问题的地方,68.4%能被它发现。这个性能水平已经接近临床应用的要求。
更重要的是分割性能,分割就是精确地勾画出病灶的边界,在图像上把肿瘤的轮廓描出来。noPriors模型达到了77.1%的Dice分数(这是一个衡量分割准确性的指标,分数越高越好)和11.7毫米的Hausdorff距离误差(这衡量边界的准确性,数值越小越好)。
noPriors模型的纵向分析能力也很强悍,AI计算出每个患者的总病灶负荷中位数为6.4立方厘米,而自动测量与手动测量的体积差异中位数仅为0.02立方厘米,两者之间的中位差值几乎可以忽略不计。
从实验结果看,加入解剖信息的withPriors模型并没有带来明显优势,反而在关键精度上略逊一筹,虽然在某些指标,比如Hausdorff距离(衡量边界误差)上稍微更好一些,但总体来说,不带先验的noPriors模型反而表现得更“有弹性”。
为何会出现这种反直觉现象?研究者也推测,这可能是因为先验信息反而限制了模型自由“想象”肿瘤形态的能力,尤其是在边缘模糊或者位置特殊的结节上。
方法评析:一场“加减法”的较量
研究团队选择了nnUNet作为基础架构,这不是偶然的决定,nnUNet就像是深度学习界的"瑞士军刀",它能够根据数据集的特点自动调整网络结构和训练参数,在多个医学图像分析竞赛中都获得了优异成绩。
关于解剖先验知识的使用,直觉上,给AI提供更多解剖信息应该有助于提高性能,就像给医学生一张详细的解剖图谱。但实验结果显示,"withPriors"模型在检测和分割性能上都略逊于"noPriors"模型。
这个现象反映了一个深刻的问题:有时候额外的信息可能会成为"噪声",反而干扰模型的学习。
不过,使用解剖先验也有其优势,"withPriors"模型生成的分割结果更好地限制在肺部区域内,而"noPriors"模型有时会在肺外区域产生假阳性。这就像给一个过于自信的医生划定了工作范围,虽然可能限制了他的"创造力",但避免了严重的误判。
在纵向分析方面,研究团队采用了一个聪明的策略,他们将有多次扫描记录的患者专门分离出来作为测试集,用单次扫描的患者数据训练模型。这种设计确保了模型能够泛化到真实的临床场景中,因为在实际应用中,医生需要分析的往往是之前从未见过的患者的随访图像。
同样,这项研究也存在一些局限性,最主要的问题是数据质量,研究团队在质量检查中发现,公开数据集中存在标注错误,包括一些不属于主要病灶的小团块被错误标记,以及某些病灶在部分切片中缺失标注。这些问题就像地图上的错误标记,会影响AI的学习效果。研究团队坦承,如果能够修正这些标注错误,模型性能可能会有进一步提升。
另一个限制是缺乏临床病理信息,数据集中没有包含患者的具体诊断信息,比如是否为非小细胞肺癌、是否有淋巴结转移等,这使得研究无法评估模型在特定疾病类型中的表现,也限制了其临床价值的全面评估。
结论:纵向追踪,突破传统诊断模式的关键创新
传统的影像AI系统就像是"静态摄影师",只能告诉你当下的状况,而这个系统更像是"电影导演",能够展现病情发展的完整故事。
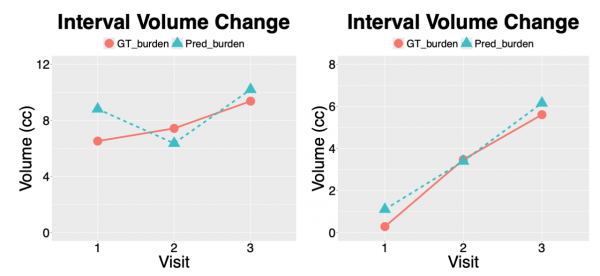
AI系统不仅能识别出所有的肺部病灶,精确分割出它们的边界,还能计算出总的病灶负荷,并追踪其随时间的变化,为每个患者生成了个性化的病灶负荷变化曲线,让医生能够一目了然地看到病情的发展趋势。
研究中展示了几个具体的患者案例。比如患者A,其总肿瘤负荷从第一次检查的约15立方厘米剧增到第二次检查的约50立方厘米,这种急剧增长提示病情恶化,需要立即调整治疗方案。而患者B在三次检查中显示稳定的缓慢增长趋势,这种模式可能提示需要密切随访但暂时不需要激进治疗。
这种能力对于某些特殊的临床场景特别有价值,比如接受靶向放射性核素治疗的晚期肺癌患者,这些患者需要频繁的CT和PET-CT检查来评估治疗效果。传统的手动测量方法不仅工作量巨大,还难以准确量化总的肿瘤负荷变化,AI系统的引入可以显著提高这些评估的效率和准确性。
在实际临床应用中,这个系统可以集成到医院的影像存档与通信系统中,成为放射科医生的智能助手。
当患者完成CT检查后,AI系统会自动分析图像,识别和分割出所有肺部病灶,计算总病灶负荷,如果患者有历史检查记录,系统还会自动进行对比分析,生成病灶变化报告。放射科医生收到的不再是原始的CT图像,而是经过AI预处理的、包含详细测量数据和变化趋势的综合报告。
这种变化的意义不仅在于提高效率,更在于提升诊断质量,手动测量存在观察者间和观察者内的变异性,特别是对于形状不规则的肿瘤,线性测量可能无法准确反映其真实大小变化,而体积测量提供了更准确和敏感的评估指标,能够更早地发现病情变化。
大规模筛查会产生海量的影像数据,人工阅片的工作量巨大,AI系统可以作为"第一道筛查网",自动识别可疑病灶并进行初步评估,将需要重点关注的病例优先提交给医生审阅。这不仅能提高筛查效率,还能减少漏诊风险。
要完美实现这些应用前景,还需要克服一些技术和实践挑战,尤其是模型的泛化能力,目前的研究基于单一数据集,需要在更多样化的患者群体和扫描设备上验证其性能。其次是与现有临床工作流程的整合,医院需要投入资源来部署和维护这些AI系统,医生也需要时间来适应新的工作模式。
至顶AI实验室洞见
早发现,早干预,这几乎是所有疾病治疗的金原则。
提前发现病灶,并分析与预测病灶的变化,这就是目前AI医疗的首要目标。
从技术发展的角度来看,这项研究代表了医学影像AI从"点状应用"向"系统性解决方案"的重要转变,它不仅解决了肺部病灶检测和分割的技术问题,更重要的是构建了一个完整的纵向分析框架,这为其他器官和疾病的类似应用提供了有益的参考。
这项研究的主要价值在于其对临床实际需求的深刻理解,研究团队没有单纯追求算法性能的极致优化,而是从实用性角度出发,构建了一个能够真正解决临床问题的完整系统,这种以问题为导向的研究思路值得借鉴。
当然,要真正实现这项技术的临床转化,还需要更多的验证工作,包括多中心临床试验、与临床标准的对比研究等。但无论如何,这项研究为肺癌诊断和监测开辟了一条充满希望的新道路,让我们看到了AI技术在精准医疗中的巨大潜力。
精准医疗,更需要“提前精准”。
论文地址:
https://arxiv.org/abs/2504.06924
END
本文来自至顶AI实验室,一个专注于探索生成式AI前沿技术及其应用的实验室。致力于推动生成式AI在各个领域的创新与突破,挖掘其潜在的应用场景,为企业和个人提供切实可行的解决方案。
Q&A:
Q: AI医疗在癌症筛查方面有什么突破吗?
A: AI医疗在癌症早期筛查方面取得了重大突破。例如,宁波人民医院使用AI胰腺癌筛查模型从7万份常规检查中发现了12例胰腺癌患者,其中6例在常规CT检查中未被发现。美国NIH的最新研究更是开发出能够追踪肺部病灶随时间变化的AI系统,不仅能发现病灶,还能预测其发展趋势,准确率达到71.3%。
Q: 现在的癌症治疗情况到底怎么样?
A: 尽管医疗技术高度发达,癌症仍是人类面临的重大挑战。全球约五分之一的人会患癌症,九分之一的男性和十二分之一的女性会死于癌症。肺癌是第一杀手,占所有癌症死亡病例的19%。从1809年首例癌症手术至今216年过去了,抗癌依然是待解难题,这也是为什么AI医疗被寄予厚望的原因。
Q: AI医疗技术会不会很快应用到医院里?
A: AI医疗技术的临床应用前景很好,可以集成到医院的影像系统中作为医生的智能助手。不过要完全实现临床转化还需要克服一些挑战,包括在更多样化的患者群体中验证性能、与现有工作流程整合等。目前已有部分医院开始试点应用,但大规模推广还需要更多验证工作。
好文章,需要你的鼓励
AI新加坡联手阿里云推出东南亚大语言模型Sea-Lion v4
新加坡人工智能机构与阿里云发布全新大语言模型Qwen-Sea-Lion-v4,专门针对东南亚语言和文化特色进行优化。该模型结合阿里云Qwen3-32B基础模型和大量东南亚地区数据集,在东南亚语言模型评估榜单中位居开源模型首位。模型支持119种语言,能在32GB内存的消费级笔记本上运行,采用字节对编码技术更好处理非拉丁文字,并具备3.2万词元上下文长度,可执行文档级推理和摘要任务。
中科大联手快手:AI视频评判员学会了“边看边想“,彻底解决视频生成质量难题
中科大联合快手等机构推出VR-Thinker技术,首次实现AI视频评判员的"边看边想"能力。该系统通过主动选择关键画面、智能记忆管理和三阶段训练,在视频质量评估准确率上达到75%-82%,特别擅长处理长视频场景,为AI视频生成的质量控制提供了突破性解决方案。
5个将在2026年改变任何企业的惊人智能体应用案例
AI智能体是下一代业务自动化工具,不仅能对话交流,还能执行复杂任务。与ChatGPT聊天机器人不同,它们可在最少人工干预下规划并完成工作。文章介绍了五个高影响力应用:自动化客户服务解决方案、销售CRM管理、合规自动化、招聘筛选与排程、市场情报报告。这些应用都具有重复性工作流程、依赖结构化数据、遵循可预测规则等特点,能够释放员工宝贵时间用于更有价值的工作。
微软研究院发布BitDistill:让大型语言模型轻松瘦身却不丢性能的魔法
微软研究院发布BitDistill技术,通过三阶段优化将大型语言模型压缩至1.58位精度,在保持性能的同时实现10倍内存节省和2.65倍速度提升。该技术包括模型结构稳定化、持续预训练适应和知识蒸馏传承三个关键步骤,解决了模型量化中的性能衰减和规模化问题,为AI模型在资源受限设备上的高效部署提供了新方案。
AI新加坡联手阿里云推出东南亚大语言模型Sea-Lion v4
5个将在2026年改变任何企业的惊人智能体应用案例
嵌套学习:谷歌又一个Transformer级别的研究?AI学习就像做梦一样层层嵌套
国家数据局公布2025年“数据要素×”大赛获奖名单:蚂蚁数科获优秀奖
超1亿用户可随时唤醒千问,夸克发布最新AI浏览器
阿里云服务器部署速度跟不上AI需求,GPU配给优先大客户
ChatGPT推出AI购物助手 生成个性化买家指南功能
Google与英伟达AI芯片竞争升级,Meta寻求合作
Mercy Ships与Presidio、思科携手推动海上医疗数字化变革
日本芯片初创公司Rapidus计划建设1.4纳米芯片制造厂
长虹佳华荣膺微软年度最佳合作伙伴大奖,云智协同驱动中国企业全球化跃迁
Hitachi Vantara推出VSP One高端块存储,赋能AI与任务关键型工作负载新时代